Hvordan fungerer egentlig en solcelle, del II: Doping
Silisium er et grunnstoff med 14 protoner i kjernen. Det er det åttende vanligste stoffet i universet (rangert etter masse), og det er det andre vanligste stoffet på Jorden. Hele 27,7% av massen til Jorden er silisium. Silisium er også en halvleder, og det er det vanligste stoffet å bruke til både elektroniske kretser og solceller.
Silisium har 14 protoner, og dermed også 14 elektroner. Litt forenklet kan vi si at disse er fordelt med 2 elektroner i innerste skall, 8 i nest innerste, og 4 i ytterste. Når vi har silisium som et fast stoff er hvert silisiumatom bundet til 4 andre. I hver av disse bindingene har vi to elektroner som er delt mellom to atomer, og det gjør at hvert atom på en måte føler at det har 8 elektroner (2 fra hver binding) i ytterste skall. Dette gjør at strukturen er stabil, og som vi var inne på
i går gjør dette at silisium har et båndgap, altså at et elektron må tilføres energi for å kunne rive seg løs og bevege seg rundt omkring.
Båndgap måles typisk i elektronvolt (eV), som er en måleenhet for energi. 1 eV er det samme som 1,6 x 10
-19 J, så det er en ganske liten enhet. Båndgapet i silisium er på 1,1 eV, og til sammenligning har synlig lys en foton-energi på mellom 1,6 og 3,4 eV. Ett foton fra Solen er altså vanligvis nok til å eksitere et elektron i silisium.
Til tross for at silisium utgjør over en fjerdedel av massen til Jorden, utgjør prisen for silisium mesteparten av kostnaden ved en solcelle. Grunnen til det er at silisium som skal brukes til solceller må være veldig rent. De beste solcellene som lages industrielt i dag, lages av silisium som er 99,9999% rent, og helst monokrystallinsk. Monokrystallinsk betyr at krystallstrukturen er helt perfekt hele veien, altså at absolutt alle atomene i et stykke silisium er bundet til fire andre, i et regulært og fint mønster som gjentar seg hele veien. Det er det å lage så rent silisium, med perfekt krystallstruktur, som koster penger.
Til tross for at man anstrenger seg voldsomt for å lage rent silisium, er ikke rent silisium i seg selv spesielt interessant. Det som er viktig er at når man begynner med helt rent silisium kan man tilsette små mengder av andre stoffer, og få god kontroll over egenskapene. Det er dette som kalles doping, og det er det som er temaet for dagens artikkel.
Jeg nevnte innledningsvis at i en silisiumkrystall har hvert atom fire elektroner i ytterste skall, og det bruker disse fire elektronene til å binde seg til nøyaktig fire andre silisiumatomer. Når man doper silisium tilsetter man for eksempel fosfor. Fosfor ligger et hakk til høyre for silisium i det periodiske systemet, og har ett elektron mer. Det som skjer når man tilsetter små mengder fosfor til veldig rent silisium er at man beholder den samme krystallstrukturen, bare at et og annet silisium-atom er byttet ut med fosfor. Fosfor-atomet er omtrent like stort som silisium, så det går helt fint. Forskjellen er at siden fosfor har fem elektroner i ytterste skall har det ett til overs når det har dannet fire bindinger til nabo-atomene sine. Dette elektronet står nokså fritt til å bevege seg i krystallen, og ved å tilsette ulike mengder fosfor kan man kontrollere ledningsevnen til silisium meget nøye. En halvleder som er dopet slik at den har elektroner som kan bevege seg, kalles en n-type halvleder.
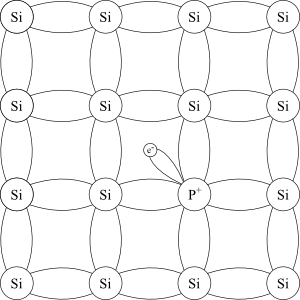
Det ekstra elektronet er relativt fritt til å flytte på seg
Hvis man i stedet for å tilsette et stoff med et elektron ekstra heller tilsetter et stoff med et elektron mindre, oppstår en annen situasjon. Bor, som ligger et hakk til venstre og ett hakk opp i forhold til silisium, er et eksempel på et slikt stoff. Bor har bare 3 elektroner i ytterste skall, så når det føyer seg inn i krystallstrukturen til silisium kan det bare danne tre fullstendinge bindinger. Bindingen til det fjerde atomet består bare av ett elektron på deling, så den blir litt sånn halvveis. Det er imidlertid slik at et elektron i en fullstending binding lett kan bevege seg og ta over den tomme plassen i en ufullstending binding, fordi elektronet vil ha like stor energi (være like sterkt bundet) i begge tilfeller. Hvis dette skjer vil imidlertid elektronet etterlate seg et positivt ladet hull. Dette hullet kan bli fylt av et annet elektron, men da oppstår det et nytt hull der det elektronet kom fra, og slik får vi den situasjonen jeg nevnte i går, altså at man tilsynelatende har et positivt ladet hull som kan bevege seg i krystallen. En halvleder som er dopet slik at den har hull som kan bevege seg kalles en p-type halvleder.
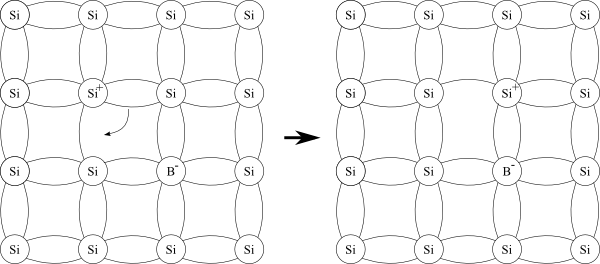
Man får tilsynelatende et positivt hull som kan flytte på seg
Og det var en kort introduksjon til doping. Neste gang, pn-overgangen.
-Tor Nordam



Comments